Der weltweit zunehmende Bedarf an pflanzlichen Lebensmitteln verlangt den Einsatz von Pflanzenschutzmitteln (Pestiziden), um Kulturpflanzen und Pflanzenerzeugnisse vor Schaderregern zu schützen. Ohne gezielte Pflanzenschutzmaßnahmen sind sichere und qualitativ hochwertige Ernten nicht möglich. Demgegenüber steht der Befund, dass der großflächige Einsatz von Pestiziden mit insektizider Wirkung zu einer signifikanten Reduktion von Insekten geführt hat. Insbesondere der Rückgang der Wildbienenpopulation stellt eine Problematik dar, da Wildbienen einen nicht unerheblichen Teil der Bestäubungsleistung erbringen und somit für landwirtschaftliche Erträge eine Voraussetzung sind.
Insektenzellen als Sensoren für Umweltgifte

Pestizide sollen „bienenfreundlicher“ werden
Dieses Dilemma zwischen notwendigem Pflanzenschutz und Schutz der Insekten scheint nur dadurch lösbar, dass Pflanzenschutzmittel entwickelt werden, die keine insektizide Wirkung haben. Um eine solche Entwicklung neuer „bienenfreundlicher“ Pestizid-Wirkstoffe zu unterstützen, arbeiten die Fraunhofer EMFT Wissenschaftlerinnen und Wissenschaftler an der Entwicklung einer Sensorik zur Identifizierung von „bienenfeindlichen“ Substanzen bereits in den frühen Entwicklungsphasen neuer Wirkstoffe. Es ist das Ziel, dass diese Sensorik die insektizide Wirkung durch sehr kurze Reaktionszeiten innerhalb weniger Stunden anzuzeigen vermag und dabei viele Substanzen parallel untersucht werden können.
Insektenzellen als Sensoren

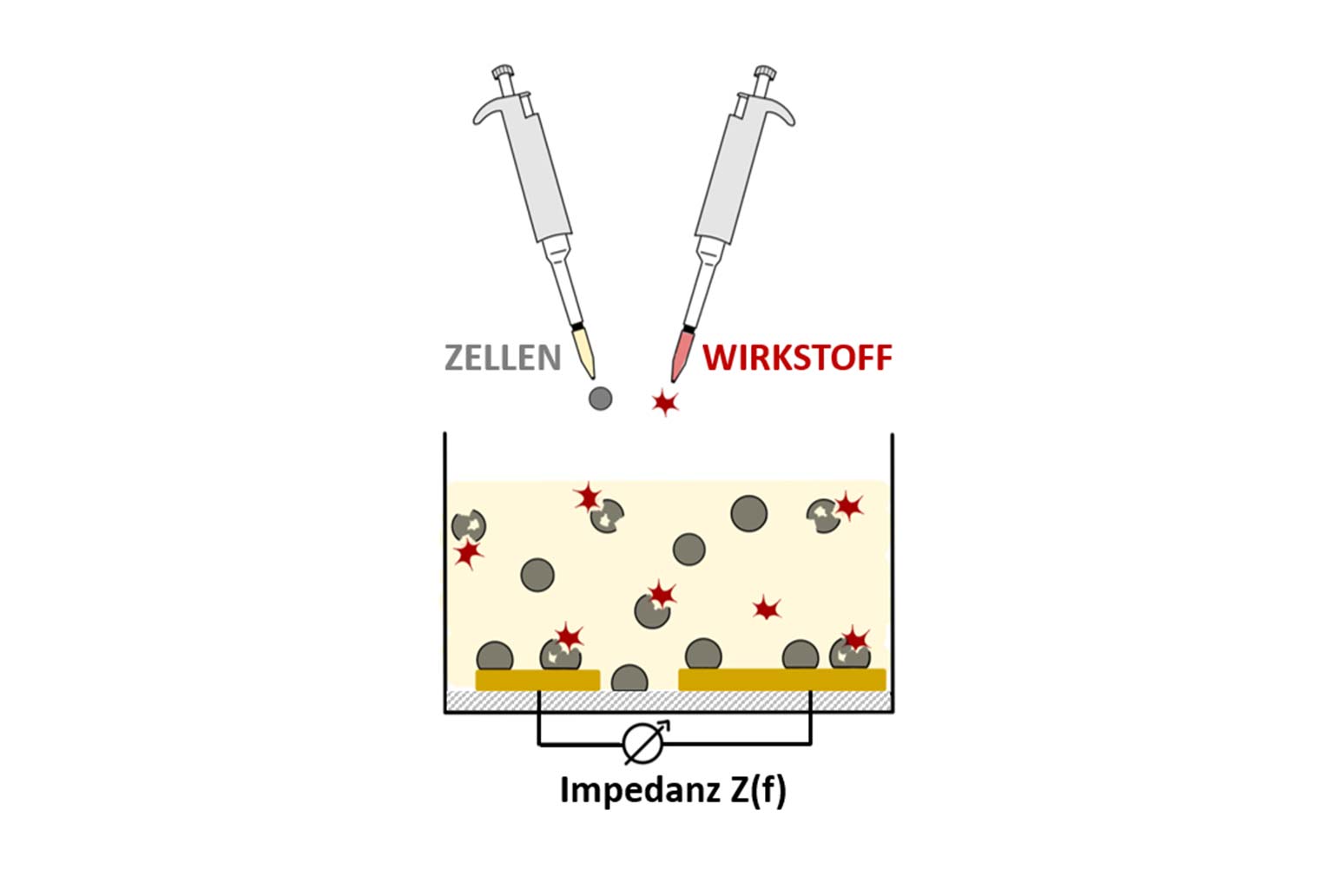
Das Grundkonzept basiert auf der Verwendung von Insektenzellen als Sensoren. Die aus Insekten isolierten Zellen lassen sich im Labor beliebig vervielfältigen und stehen darum unbegrenzt zur Verfügung. Die nur wenige Mikrometer großen Zellen verfügen über den für die jeweiligen Insekten charakteristischen Stoffwechsel und können bei Kontakt mit einem potentiellen Wirkstoff dessen Beeinflussung des Zellstoffwechsels anzeigen. Zur Durchführung der Messungen werden die suspendierten, vereinzelten Insektenzellen in Gefäße überführt, die am Boden über Mikroelektroden verfügen. Mit Hilfe dieser Elektroden lassen sich elektrochemische Impedanzmessungen mit hoher zeitlicher Auflösung (in Echtzeit) durchführen, die den zeitlichen Verlauf des Anlagerns der Zellen an die Oberfläche der Elektroden (Zelladhäsion) dokumentieren. Da der Prozess des Anlagerns der Zellen an die Elektrode sehr sensitiv für eine Beeinflussung durch Stoffe ist, die den Zellstoffwechsel verändern, erlauben diese Messungen eine insektizide Wirkung sehr schnell und ohne lange Laborzeiten zu identifizieren. Anders als bei typischen Biosensoren, wird in diesem Ansatz nicht die Konzentration einer Substanz ermittelt, sondern deren biologische Wirkung auf die Zellen einer Insektenart (Dosis-Wirkungs-Beziehung). Dieser Ansatz lässt sich grundsätzlich auf Zellen verschiedener Insektenarten anwenden, so dass unter Verwendung von solchen Multielektroden-Arrays zukünftig die biologische Wirkung einer gegebenen Substanz auf verschiedene Insektenspezies ermittelt werden kann.
Aktueller Entwicklungsstand
Für zukünftige Anwendungen der Sensorik im Feld ist eine Entkopplung der Zellkulturarbeit im Labor vom eigentlichen Toxizitätstest zwingend erforderlich. Dazu werden die suspendierten, vereinzelten Insektenzellen direkt in den Vertiefungen der Multielektroden-Arrays eingefroren und die mit Zellen beladenen Multielektroden-Arrays bei sehr niedrigen Temperaturen gelagert. Die Zellen können jederzeit aufgetaut werden, um den Test auf eine akute insektizide Wirkung auf die Zellen durchzuführen. Der zellbasierte Biosensor ist nach dem Auftauen der Zellen innerhalb von Minuten testbereit und damit unabhängig von einem Zellkulturlabor oder einer Laborumgebung im Allgemeinen. Dies ermöglicht eine zeit- und kosteneffiziente Vorbereitung großer Chargen an Sensorzellen Wochen oder sogar Monate vor dem Zeitpunkt, an dem der eigentliche Assay durchgeführt wird.
Fünf verschiedene Pestizidformulierungen wurden bisher mit dieser optimierten Sensorik auf ihre konzentrationsabhängige akute Zelltoxizität (Dosis-Wirkungs-Beziehung), ausgedrückt als Konzentration der halbmaximalen Wirkung (EC50), mittels Impedanzmessungen untersucht. Die Validierung mit einem kommerziellen, gut etablierten Zellviabilitätsassay zeigt eine gute Übereinstimmung in Bezug auf die Konzentrationen der halbmaximalen Wirkung. Auch stimmen die Daten mit denen unter Verwendung "frischer" Zellen überein, die vor dem Test nicht eingefroren wurden. Unsere Studien zeigen, dass einige Pestizide, die für den Hausgebrauch verkauft werden, eine zelltoxische Wirkung bei Konzentrationen aufweisen, die weit unter der empfohlenen Anwendungskonzentration des Herstellers liegen, und dass sie giftiger sind als solche Formulierungen, die nur für die landwirtschaftliche Industrie verkauft werden.
Um die Anwendung der zellbeladenen Elektrodenarrays vollständig zu automatisieren, hat das Forschungsteam am Fraunhofer EMFT ein Tischgerät entwickelt, welches das Auftauen der Zellen und die Probenzugabe übernimmt. Das kubische 32,4 cm x 31,4 cm x 31,1 cm kleine Gerät verfügt über eine aktive Heizung, einen Halter für zwei Elektrodenarrays und ein lineares Robotersystem, um letztere in kartesischen Koordinaten zu bewegen. Diese Bewegung ermöglicht es dem System, jede Vertiefung des Elektrodenarrays über eine Dosiernadel mit einer Pestizidlösung mit genau definierter Konzentration zu befüllen. Alle relevanten Parameter können über einen Touchscreen direkt am Gehäuse eingestellt werden.
Die Flüssigkeit wird im Freistrahlverfahren appliziert, so dass die Nadel nie mit dem Medium in den Vertiefungen in Berührung kommt und somit jegliche Kreuzkontamination ausgeschlossen ist. Eine am Fraunhofer EMFT entwickelte Metall-Mikropumpe sogt im System für eine exakte Dosierung für eine Vielzahl von Flüssigkeiten.
Demonstrator für den Test von bienenfreundlichen Pestiziden
Ausblick: Komplettes Wirkprofil statt nur Toxizität ermitteln
Neben dem grundsätzlichen Nachweis einer akuten insektiziden Wirkung, soll die vorgestellte Sensorik im weiteren Projektverlauf zu einer multiparametrischen Untersuchung verschiedener Zellfunktionen (Phänotypen) dienen. Durch eine geänderte Experimentführung kann aus den Impedanzsignalen bei unterschiedlichen Frequenzen des eingesetzten Wechselstroms auf die Zellteilungsrate, die Zellwanderung oder die Zellbeweglichkeit geschlossen werden, so dass insgesamt ein Wirkprofil der Kandidatensubstanz entsteht, das über deren reine akute Toxizität hinausgeht.